Лишняя аминокислота, или зачем учёным потребовалась новая форма жизни
В последние пара месяцев уже много раз в массмедиа пробегали сообщения о тех либо иных «коррективах», вносимых новыми данными в привычные представления об эволюции, и новых теориях, выдвигаемых на основании каких-либо открытий.
Поправки вносились в представления о том, в каких условиях существует жизнь и где направляться её искать.
Новые неожиданные открытия подвергали сомнению общепринятые положения об его расселении и эволюции человека по Земле.
Самой тяжёлой, но, артиллерией в этом отношении выясняются генетики: их заключения становятся иногда совсем революционными.
Но создание новой формы судьбы уже из второй области.
А именно это событие и случилось недавно.
Честно говоря, создание учёных из университета Scripps Research — не совсем новое существо. Это, в случае если пользоваться технической терминологией, модификация уже существующего организма — причём достаточно известного и очень обширно распространённого.
Речь заходит об «обычной» кишечной палочке Escherichia coli (E. coli), очень устойчивом ко всяким экстремальным условиям вредном микроорганизме, обитающем в кишечниках и желудках млекопитающих.
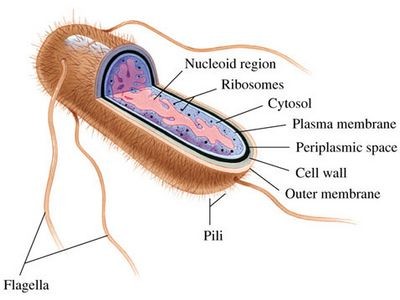
Строение кишечной палочки.
И одновременно с этим, учёные добились того, что их создание с чистой совестью возможно назвать новой формой судьбы.
Потому, что аминокислотных оснований в генетическом коде «новодела» — не двадцать, а двадцать одно.
Большинство естественных белков содержат двадцать аминокислотных остатков (АКО). Не смотря на то, что барьер данный, нужно сообщить, далеко не полон.
Кое-какие микробы выработали у себя свойство образовывать «нестандартные» аминокислоты, такие как селеноцистеин и пирролизин, к примеру. Но, это всего лишь мало видоизменённые варианты лизина и цистеина.
Но куда больший интерес для учёных воображает возможность вводить в натуральные белки другие нестандартные аминокислоты.
Это было бы очень полезно для медицинских изучений.
К примеру, кое-какие белки, применяемые в терапевтических целях, нуждаются в добавлении разных химических групп, таких как полимеры, соединения с поперечной связью и цитотоксичные молекулы.
Разработка, использованная экспертами Scripps может применяеться и в базисных биомедицинских изучениях. К примеру, существуют аминокислоты, которые содержат флуоресцентные группы, каковые возможно применять чтобы «метить» белки, и следить за их взаимодействием и поведением с клетками in vivo.
Помимо этого, кислоты и гидрофобные аминокислоты, связывающие тяжёлые металлы, и кислоты, которые содержат спиновые метки, смогут быть использованы для зондирования протеиновых структур, в каковые их вводят.
Неестественные аминокислоты, которые содержат такие компоненты, как, к примеру, кето-группы, возможно применять для присоединения к ним дополнительных химических структур, к примеру, молекул сахаров, что разрешит создавать новые лекарства на протеиновой базе.
Как явствует из особого пресс-релиза, учёных, как в большинстве случаев, интересует не столько факт создания, по сути, новой формы судьбы, сколько использование на практике их технологии.
В самом внедрении неестественных аминокислот в белки нет ничего нового, но прежде такие манипуляции возможно было проводить лишь в пробирке. А бактерия с 21 аминокислотой, как уже указано, сама способна производить модифицированные белки.
Схема, изображающая строение аденина.
Создать саму бактерию его коллегам и Шульцу удалось благодаря избыточности генетического кода.
В момент экспрессии белка, фермент считывает ДНК-основания гена (аденин, гуанин, тимин и цитозин) и транскрибирует их в РНК (аденин, гуанин, урацил и цитозин).
Информационная РНК (иРНК) после этого переводится рибосомой в белок. Рибосоме требуется помощь молекул транспортной РНК (тРНК), «заряженной» аминокислотой, а для этого требуется помощь «заряжающего» фермента.
Любая тРНК распознаёт отдельную трёхосновную комбинацию (кодон) в информационной РНК и «заряжается» лишь одной аминокислотой, характерной этому кодону.
В ходе синтеза белков, тРНК, характерная для следующего кодона в иРНК, приходит уже «заряженной» нужной аминокислотой, и рибосома захватывает её и присоединяет к растущей протеиновой цепочке.
Избыточность генетического кода проистекает из факта существования большего количества кодонов, чем применяемых аминокислот. Существует 64 разных метода формирования кодона — либо любой трёхзначной комбинации четырёх «букв» (УАГ, АЦГ, УТЦ и без того потом).
А аминокислот употребляется (в большинстве случаев) всего лишь 20.
Но природа применяет кое-какие из излишних кодонов: часть из них кодируют одинаковые кислоты, и лишь три из 64 кодонов не кодируют по большому счету никаких аминокислот.
Эти кодоны имеют ответственное значение, потому, что в большинстве случаев, в то время, когда синтезирующая рибосома натыкается на несмысловой кодон, она отделяется от иРНК и синтез заканчивается.
Так, несмысловые кодоны именуют ещё и стоп-кодонами. Один из них, узнаваемый называющиеся «янтарный стоп-кодон» (урацил-аденин-гуанин — УАГ), сыграл ключевую роль в изучениях Шульца.
Шульц знал, что если он введёт в клетки молекулу тРНК, которая распознаёт УАГ (известную как янтарный супрессор), и фермент, несущий янтарный супрессор с нестандартной аминокислотой, ему удастся отыскать метод внедрять нестандартную аминокислоту в любой протеин.
Благодаря данной совокупности, рибосома, считывающая иРНК, внедрит нестандартную кислоту в тот момент, в то время, когда ей встретится УАГ. Более того, любой кодон в иРНК, преобразованный в УАГ, будет кодировать новую аминокислоту в том же самом месте, давая его коллегам и Шульцу возможность внедрять эти новые кислоты в белки в том месте, где им необходимо.
Применяя данный способ, его коллеги и Шульц вводили кислоту О-метил-L-тирозин в белки с точностью переноса более 99% — практически как у естественных аминокислот. Потом то же самое удалось выполнить с рядом вторых кислот, а также p-аминофенилаланином, той самой 21 аминокислотой бактерии.
Плазмиды, визуализированные посредством электронного микроскопа.
Потом, добавив плазмиды — циркулярные фрагменты ДНК, каковые приводят к экспрессии метаболических генов, нужных для производства p-аминофенилаланина, — учёные «обучили» бактерию производить личные нестандартные аминокислоты и внедрять их в любой протеин, кодируемый иРНК, содержащей кодон УАГ.
Сейчас учёным предстоит сравнить неповторимую бактерию, содержащей 21 аминокислоту с её «родственницей», простой кишечной палочкой с 20 аминокислотами, и узнать, как и как различаются их выживаемость и эволюционная адекватность.



