Правило фаз
Диаграммы состояний являются графиками, линии которых показывают температурные и концентрационные границы существования тех либо иных фаз в равновесных сплавах. Линии диаграммы состояний дробят ее на области, которым соответствует в двойных совокупностях устойчивое существование одной либо двух фаз.
Наряду с этим фазы, существующие в той либо другой области, ни при каких обстоятельствах не повторяются в том же сочетании в какой-либо второй смежной области. Из этого следует, что переход фигуративной точки из одной области диаграммы в другую при перемещении по какой-нибудь ординате вверх либо вниз, и по какой-нибудь абсциссе вправо либо влево постоянно характеризует некое фазовое превращение, т. е. появление какой-то новой либо исчезновение какой-то до того существовавшей фазы.
На смещение равндвесия совокупности в том либо другом направлении, т. е. протекание тех либо иных фазовых превращений в равновесных совокупностях, влияет изменение внешних и внутренних факторов равновесия. Под внешними факторами в большинстве случаев знают давление и температуру, а под внутренними — концентрацию компонентов в фазах.
Учитывая изложенное, возможно выяснить совокупность, как совокупность фаз, в которой в виде фазовых превращений может осуществляться сотрудничество компонентов, определяемое концентрацией последних в разных фазах, и внешними факторами равновесия — давлением и температурой.
Оказывается, что в равновесной совокупности число фаз, могущих существовать совместно, не может быть произвольным и связано строгой зависимостью с числом компонентов совокупности, числом внешних факторов равновесия (температура и давление) и числом степеней свободы. Эта зависимость носит название
Правило фаз охватывает поведение одно-, двух-, трех- и многокомпонентных совокупностей. Оно разрешает растолковать вид кривых, приобретаемых при термическом анализе сплавов; с его помощью возможно проверить правильность построения тех либо иных Диаграмм состояний.
Однокомпонентная железная совокупность, к примеру свинец, при охлаждении из жидкого состояния испытывает фазовое превращение, характеризуемое термической кривой abed с температурной остановкой на участке be, в течение которой происходит кристаллизация свинца при постоянной температуре 327°.
Вторая однокомпонентная совокупность, к примеру чистое железо, пРи охлаждении из области больших температур испытывает фазовое превращение в виде аллотропического превращения у-железа в а-железо, пребывающего в перестройке пространственной кристаллической решетки. Термическая кривая, характеризующая это превращение, имеет принципиально сходный ИД с кривой кристаллизации свинца.
Правило фаз обосновывает, что кристаллизация любого чистого металла из жидкого состояния либо аллотропическое превращение чистого металла постоянно происходит при постоянной температуре. Дабы убедиться в этом, достаточно выяснить число степеней свободы для совокупностей, испытывающих названные превращения.
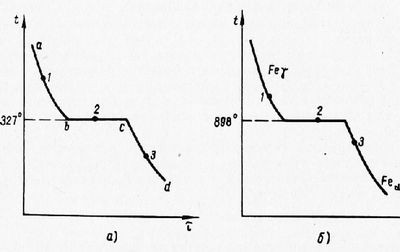
Рис. 1. Термические кривые охлаждения: а — свинца; б — железа в зоне превращения гамма-альфа
Число компонентов для случая чистого свинца равняется единице. Число фаз у кристаллизующегося, но еще не закристаллизовавшегося всецело свинца равняется двум: одна фаза — жидкий свинец, вторая — жёсткий свинец. Подставляя число компонентов и число фаз в уравнение правила фаз, возможно видеть, что число степеней свободы, либо вариантность для этого случая равняется нулю, в частности: С = 1 — 2 + 1 = 0.
Совокупность не имеет ни одной степени свободы — она безвариантна либо нонвариантна. А это и свидетельствует именно то, что без трансформации числа сосуществующих фаз для однокомпонентной совокупности в ходе кристаллизации нельзя изменять температуру ни в ту, ни в другую сторону: при нагреве выше точки плавления свинца (327°) провалится сквозь землю жёсткая фаза, а при охлаждении ниже данной точки провалится сквозь землю жидкая фаза.
Определение по правилу фаз вариантности совокупности (чистого винца) в точке 1, где имеется одна жидкая фаза, с и в точке 3, где имеется одна жёсткая фаза, показывает, что совокупность в другом случай и том имеет одну степень свободы (од-новариантная либо моновариантная совокупность). Иначе говоря не изменяя числа фаз, в этих обоих случаях возможно в известных границах изменять температуру.
Рис. 2. Иллюстрация к рассмотрению правила фаз применительно к диаграмме I типа
Рис. 3. Иллюстрация к рассмотрению правила фаз применительно к диаграмме III типа
Те же расуждения применимы и к точкам 1 и 3 на рис. 25,6 Для чистого железа в виде модификаций у и а. си И Рассмотрении диаграмм состояний двухкомпонентных стем, к примеру первого и третьего типов (рис. 26 и 27), пра-ло фаз разрешает выяснить число степеней свободы совокупности, Рактеризуемой фигуративной точкой в любой из областей диа-
Из этого следует, что для любой диаграммы состояний двух-компонентной совокупности все однофазные сплавы имеют две степени свободы, двухфазные — одну, а трехфазные — ни одной.
Разглядим, к примеру, сплавы, относящиеся к диаграмме состояний I типа, при разном числе фаз.
Для области выше линии ликвидус АЕВ характерно состояние однофазного жидкого раствора. Таковой жидкий раствор имеет две степени свободы. Иначе говоря не меняя числа фаз, возможно в известных пределах поменять, во-первых, температуру жидкого раствора, а во-вторых, его концентрацию, что достигается методом добавления компонента А либо В.
Между линией ликвидус АЕ и эвтектической горизонталью СЕ (точка 2) сплав складывается из двух фаз: жёсткой в виде чистого компонента А и жидкой в виде раствора В и А состава, отвечающего точке Ь. Таковой двухфазный сплав имеет лишь одну степень свободы. Вправду, в этом случае возможно независимо поменять лишь один фактор равновесия по выбору: либо температуру, либо концентрацию фаз.
Для начала примем за степень свободы возможность изменять температуру.
Не меняя числа фаз, температуру возможно варьировать в пределах от ликвидуса до солидуса. Но в случае если температура выбрана (к примеру, точка 2), то концентрация (состав) фаз, находящихся в равновесии между собой при данной температуре, сейчас всецело зависит от нее и определяется по правилу отрезков (точки а и Ь).
Из изложенного направляться серьёзный вывод, что в отличие от однокомпонентной совокупности, где чистый компонент кристаллизуется при постоянной температуре (безвариантная совокупность), в двух-компонентной совокупности при диаграммы первого типа чистый компонент кристаллизуется в промежутке температур от ликвидуса до эвтектической горизонтали (одновариантная совокупность). Ясно исходя из этого, что и кривая охлаждения в температурной точке, соответствующей началу кристаллизации чистого компонента, не дает остановки, а только испытывает перелом, т. е. начинает идти более полого, что говорит о замедлении охлаждения благодаря выделения теплоты кристал-изации свинцом, неспешно выпадающим из жидкого раствора в указанном температурном промежутке.
В случае если принять за степень свободы концентрации находящихся в равновесии фаз (в этом случае нужно будет назначить состав жидкой фазы, поскольку состав жёсткой фазы, выделяющейся в ходе кристаллизации, одинаковый), то температура окажется в соответствии с правилом отрезков зависимой от выбранного состава фаз.
Сплав, охлажденный до точки 3, перед кристаллизацией эвтектики содержит две фазы: жёсткую — избыточный компонент А и жидкую — раствор эвтектической концентрации, фазовое превращение при температуре эвтектической горизонтали (точка 3) пребывает в кристаллизации жидкого эвтектического раствора с образованием двухфазной механической смеси кристаллов компонентов А и В, именуемой эвтектикой. Кристаллы избыточного компонента А и кристаллы компонента А в эвтектике составляют одну (жёсткую) фазу, кристаллы компонента В — вторую (жёсткую) фазу, а кристаллизующийся, но еще не закристаллизовавшийся жидкий раствор эвтектической концентрации — третью (жидкую) фазу.
Так, в ходе кристаллизации любого двухкомпонентного сплава при эвтектической температуре постоянно имеется три фазы. Следовательно, совокупность в точке 3 безвариантна: не меняя числа сосуществующих фаз, нельзя изменить ни температуры, ни концентрации фаз.
Из этого следует второй серьёзный вывод: правило фаз растолковывает и обосновывает неизбежность кристаллизации жидкого раствора эвтектической концентрации при постоянной температуре, однообразной для всех доэвтектических и заэвтектических сплавов.
По окончании кристаллизации эвтектики сплав переходит в двухфазное состояние и получает одну степень свободы, т. е. в точке 4 совокупность моновариантна.
Приложение правила фаз к диаграмме III типа говорит о том, что сплав в точке 1 (однофазный жидкий раствор) имеет две степени свободы. Между линиями солидус и ликвидус (точка 2) сплав будет в двухфазном состоянии (жидкий раствор + жёсткий раствор) и владеет одной степенью свободы.
К нему приложимы все главные рассуждения, приведенные для точки 2 на диаграмме I типа. Отличие пребывает в том, что из жидкого раствора при кристаллизации выделяется не чистый компонент А, а жёсткий раствор компонента В в компоненте А состава, определяемого точкой п. Соответствующий Жидкий раствор имеет концентрацию т.
Кристаллизация жёсткого раствора из жидкого протекает не Ри постоянной температуре, а в промежутке температур и вызы-ает перелом, но не остановку на термической кривой.